Behandling av Escherichia coli pyelonefritt med peroral mecillinam (pivmecillinam) (29.05.24)
Farmakokinetikk og -dynamikk og konsekvenser for tolkning av resistensbestemmelse
Ansvarlig: Paul Christoffer Lindemann (paul.christoffer.lindemann@helse-bergen.no)
Dato: 28. mai 2024
Bakgrunn
Kliniske brytningspunkter fra NordicAST (versjon 14, 2024) for Enterobacterales og mecillinam gjelder ved ukompliserte nedre urinveisinfeksjoner. I Norge (og Danmark) er det imidlertid klinisk tradisjon for å behandle pyelonefritt med peroral mecillinam (pivmecillinam) hos pasienter med mindre alvorlig klinikk(1). I norske antibiotikaretningslinjer er peroral mecillinam anbefalt for behandling av pyelonefritt i allmennpraksis (400 mg x 3), og som peroral etterbehandling etter intravenøs behandling i sykehus (400 mg x 4) (1, 2). Nedenfor drøftes denne praksisen i lys av farmakokinetiske og -dynamiske (PK/PD-) beregninger. Tidligere versjoner av dette dokumentet omhandlet også peroral amoksicillin. Dette er nå utelatt da oppdaterte kliniske brytningspunkter åpner for peroral behandling med amoksicillin for alle infeksjoner utgående fra urinveier.
Datagrunnlag og vurdering
Farmakokinetikk- og dynamikk
Det er en del variasjon i de farmakokinetiske parametere som finnes i litteraturen, og spesielt er toppkonsentrasjonen ved inntak av henholdsvis 200 og 400 mg peroral mecillinam overlappende. Tidligere antakelser om lineær kinetikk, altså at toppkonsentrasjonen dobles ved doblet dose, medfører sannsynligvis ikke riktighet. Dog er det få studier som sammenligner serumkonsentrasjon ved de ulike dosene. En økning av dosen fra 200 til 400 mg, vil medføre en økning av toppkonsentrasjon med cirka 50% (3). Et sammendrag av sentrale farmakokinetiske- og dynamiske data for peroral mecillinam er presentert i Tabell 1. Figur 1 viser estimert plasmakonsentrasjon av mecillinam etter ulike doser av peroral mecillinam.
Det finnes sparsomt med tilgjengelige Monte Carlo simuleringer som undersøker sannsynligheten for å oppnå det farmakodynamiske målet ved peroral mecillinam mot uropatogene mikrober. En dansk gruppe tilknyttet Statens Serum Institut i Danmark publiserte i 2008 en poster der man har utført simuleringer på peroral mecillinam. Av Figur 2 ser man at for mecillinam 273 mg (ekvivalent med 400 mg peroral mecillinam) x 3 først ved 30% T>MIC har en adekvat sannsynlighet for måloppnåelse (PTA – probability of target attainment) ved MIC mellom 0,5 og 1 mg/L (10).
Det er knyttet en del usikkerhet til tilgjengelige farmakokinetiske data og simuleringer basert på disse. Vi har derfor i tillegg gjort en teoretisk estimering av tid over MIC for ulike, aktuelle doseringsregimer av peroral mecillinam. For å forenkle beregningene er toppkonsentrasjonen for 200 og 400 mg satt til henholdsvis 2 og 4 mg/L. Halveringstiden som er benyttet er 60 minutter. Resultatene er vist i Tabell 2.
Fra EUCAST er det p.t. kun tilgjengelig en tentativ ECOFF (TECOFF) for E. coli og mecillinam (Se Figur 3). Endringen fra tidligere skyldes en relativt nylig gjennomgang av alle data i EUCAST-databasen, der flere MIC-distribusjoner er funnet ikke å tilfredsstille kravene til EUCAST. Til tross for at TECOFF nå er redusert fra en ECOFF på 1 mg/L til 0,5 mg/L, viser korrelasjonsdata for lappediffusjonsmetoden at den nye TECOFF ikke passer godt med den mer pålitelige sonediameter ECOFF på 20 mm. Basert på mangeårig erfaring fra Norge med bruk av en grense på MIC ≤1 mg/L og sonediameter ≥ 20 mm for bruk av peroral mecillinam på pyelonefritt, har vi derfor valgt å basere anbefalingen på den tidligere ECOFF på 1 mg/L som da korrelerer godt med en sonediameter på 20 mm (Se Figur 5).
En viktig begrensning med denne teoretiske beregningsmodellen, er at man benytter konsentrasjonen av mecillinam i plasma. En human farmakokinetisk studie har vist at konsentrasjonene i nyrevev i gjennomsnitt er 1,4 ganger høyere enn i plasma (7). Dette kan støtte at man aksepterer et noe lavere farmakodynamisk mål (T>MIC), sammenlignet med andre systemiske infeksjoner.
Basert på disse teoretiske beregningene, er det holdepunkter for at man oppnår en tilfredsstillende T>MIC ved både 400 mg x 3 og 400 mg x 4 til å kunne dekke E. coli med MIC ≤1 mg/L. Det er derimot sterke holdepunkter for at man ikke oppnår en tilstrekkelig høy serumkonsentrasjon til å kunne dekke hele den følsomme populasjonen av E. coli (MIC ≤ 8 mg/L).
AFA mener det er tilstrekkelig grunnlag for å si at peroral mecillinam dosert 400 mg x 3-4 dekker E. coli med MIC ≤1 mg/L, og at dette derfor kan anses som et adekvat behandlingsvalg også ved pyelonefritt med mindre alvorlig klinikk. Hvorvidt det er grunnlag for å si at en dosering på 400 mg x 4 også vil dekke isolater med MIC > 1 mg/L, er mer usikkert. En norsk studie har sammenlignet peroral mecillinam 400mg x 4 med ciprofloksacin som peroral etterbehandling etter urosepsis (11). I denne studien argumenterte forfatterne for at denne dosen skal dekke isolater med høyere MIC basert på det bakteriostatiske farmakodynamiske målet (T>MIC 30-35%). Det var kun fire pasienter med E. coli UVI med mecillinam MIC på 2-8 mg/L i denne studien.
Resistensmekanismer
Til tross for over 40 års bruk av peroral mecillinam som standardbehandling for UVI i Danmark, Norge og Sverige, er fortsatt 95 % av E. coli klassifisert som følsomme. En av årsakene til dette er at mecillinam-resistens ofte medfører en betydelig kostnad for bakterien slik av den ikke overlever (12). Den viktigste mekanismen hos de overlevende mutantene er en mutasjon i cysB-genet som koder for CysB-proteinet. Dette er den viktigste positive regulatoren av cysteinbiosynteseveien, og in-vitro mecillinamresistens oppstår når denne veien slås av, men bare i vekstmedier med lavt cysteininnhold. Interessant nok viser det seg at tilstedeværelse av cystein i mediet reverserer motstanden mot mecillinam, og cystein er nesten alltid til stede i urinen (13, 14).
Kliniske studier og evidens
Det er god dokumentasjon for effekt av peroral mecillinam ved ukomplisert cystitt, og norske retningslinjer anbefaler peroral mecillinam som ett av tre førstehåndsmidler mot akutt cystitt (komplisert og ukomplisert). En litteraturgjennomgang fra 2018 identifiserte 12 kliniske studier om peroral mecillinam ved pyelonefritt (15). Oversikten konkluderer med at peroral mecillinam kan være egnet til behandling av pediatrisk pyelonefritt og mindre alvorlig pyelonefritt hos voksne, at det er behov for kliniske studier, men at det mangler evidens for at mecillinam kan anbefales ved bakteriemi eller sepsis. I en norsk studie ble mecillinam 400mg x 4 benyttet som peroral hale etter tre dagers parenteral behandling av E. coli urinveisinfeksjon med bakteriemi (11). 44 av 50 pasienter nådde primærendepunktet etter 7 dager (afebril, klinisk bedring og ikke behov for ytterligere behandling).
Oppsummering og anbefalinger
AFA mener det er tilstrekkelig grunnlag for å si at peroral mecillinam dosert 400 mg x 3-4 er egnet til behandling av mindre alvorlig pyelonefritt forårsaket av E. coli med MIC for mecillinam ≤ 1 mg/L (sonediameter ≥ 20 mm). Det finnes noen kliniske studier og PK/PD-beregninger som støtter dette. Behandling av klinisk følsomme isolater av E. coli med MIC 2-8 mg/L (sonediameter 15-19 mm) er mer usikkert – selv med dosering 400 mg x 4. For andre Enterobacterales finnes enda mindre data, og ECOFF, MIC-verdier og sonediametere er ikke direkte sammenlignbart (16). Denne anbefalingen er derfor begrenset til E. coli. Anbefalingen gjelder også bruk av peroral mecillinam som peroral hale etter adekvat intravenøs behandling.
AFA anbefaler varsomhet ved behandling av pyelonefritt forårsaket av E. coli med peroral mecillinam, og vil anbefale at resultatet av mecillinam svares med følgende kommentar på isolater med MIC ≤ 1 mg/L eller sonediameter ≥ 20 mm:
«Kliniske brytningspunkter for peroral mecillinam gjelder ukompliserte, nedre urinveisinfeksjoner. Dette isolatet har en MIC for mecillinam ≤ 1 mg/L og høydose peroral mecillinam (400 mg x 3-4) kan i slike tilfeller være effektivt ved pyelonefritt med mindre alvorlig forløp.»
Referanser
1. Helsedirektoratet (2012). Nasjonal faglig retningslinje for antibiotika i primærhelsetjenesten [nettdokument]. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-primaerhelsetjenesten (2023-09-07)
2. Helsedirektoratet (2013). Antibiotika i sykehus [nettdokument]. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus (2023-09-07)
3. Roholt K. Pharmacokinetic studies with mecillinam and pivmecillinam. J Antimicrob Chemother 1977; 3 Suppl B: 71-81.
4. Bornemann LD, Castellano S, Lin AH et al. Influence of food on bioavailability of amdinocillin pivoxil. Antimicrob Agents Chemother 1988; 32: 592-4.
5. Jeppesen N, Frimodt-Moller C. Serum concentrations and penetration into prostate of mecillinam and ampicillin. Curr Med Res Opin 1984; 9: 213-8.
6. Kerrn MB, Frimodt-Moller N, Espersen F. Urinary concentrations and urine ex-vivo effect of mecillinam and sulphamethizole. Clin Microbiol Infect 2004; 10: 54-61.
7. Ostri P, Frimodt-Moller C. Concentrations of mecillinam and ampicillin determined in serum and renal tissue: a single-dose pharmacokinetic study in patients undergoing nephrectomy. Curr Med Res Opin 1986; 10: 117-21.
8. Sun LN, Zhao Y, Gao HY et al. LC-MS/MS methods for determination of unstable pivmecillinam and mecillinam in acidified human plasma: Application to a pharmacokinetic study. J Sep Sci 2022; 45: 2543-54.
9. MacGowan A. Revisiting Beta-lactams - PK/PD improves dosing of old antibiotics. Curr Opin Pharmacol 2011; 11: 470-6.
10. Skovbo Jensen K, Santerre Henriksen A, Frimodt-Moller N. Pivmecillinam: Estimation of adequate dosage for susceptible and ESBL-producin E. coli by Monte Carlo PK/PD simulation. ECCMID 2008. Barcelona 2008.
11. Hansen BA, Grude N, Lindbaek M et al. The efficacy of pivmecillinam in oral step-down treatment in hospitalised patients with E. coli bacteremic urinary tract infection; a single-arm, uncontrolled treatment study. BMC Infect Dis 2022; 22: 478.
12. Thulin E, Sundqvist M, Andersson DI. Amdinocillin (Mecillinam) resistance mutations in clinical isolates and laboratory-selected mutants of Escherichia coli. Antimicrob Agents Chemother 2015; 59: 1718-27.
13. Thulin E, Thulin M, Andersson DI. Reversion of High-level Mecillinam Resistance to Susceptibility in Escherichia coli During Growth in Urine. EBioMedicine 2017; 23: 111-8.
14. Frimodt-Moller N. Mecillinam - Reversion of Resistance and How to Test It. EBioMedicine 2017; 23: 4-5.
15. Jansaker F, Frimodt-Moller N, Benfield TL et al. Mecillinam for the treatment of acute pyelonephritis and bacteremia caused by Enterobacteriaceae: a literature review. Infect Drug Resist 2018; 11: 761-71.
16. European Committee on Antimicrobial Susceptibility Testing. Data from the EUCAST MIC distribution website. http://mic.eucast.org (2024.05.28)
Tabell 1. Sentrale farmakokinetiske- og farmakodynamiske data for peroral mecillinam. (3-8)
|
Dosering |
200 mg x 1 p.o. |
400 mg x 1 p.o. |
|
Biotilgjengelighet |
60-75 % |
|
|
Halveringstid |
60-70 minutter |
|
|
Proteinbinding |
5-10 % |
|
|
PD-mål bakteriostase (target attainment), %T>MIC (9) |
30-35 % |
|
|
CMAX [mg/L] 1 |
1,7 - 3,3 |
2,5 - 5,2 |
|
Tentativ ECOFF [mg/L] 2 |
(0,5) |
|
|
MIC-bp [S≤/R>] 3 |
8/8 |
|
|
1 Gjelder konsentrasjon av mecillinam (aktiv substans) 2 For E. coli. Fra mic.eucast.org, se Figur 3 3 Fra NordicAST brytningspunkttabell versjon 13.0 |
||
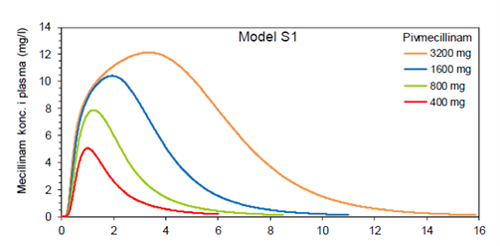
Figur 1 Estimert plasmakonsentrasjon av mecillinam ved ulike doseringer peroral mecillinam. Basert på Roholt et al.(3), figuren er gjengitt med tillatelse av Klaus Skovbo Jensen og Nils Frimodt-Møller.
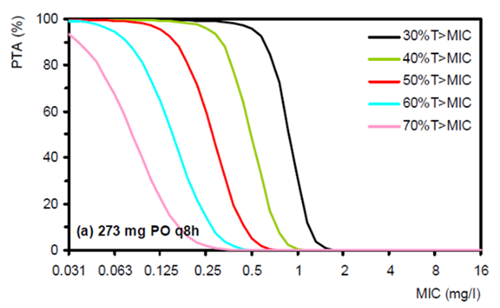
Figur 2 Sannsynlighet for måloppnåelse (PTA - probability of target attainment) for mecillinam 273 mg x 3 (ekvivalent med peroral mecillinam 400 mg x 3) for ulike farmakodynamiske mål (10).
Tabell 2. Teoretisk beregning av farmakokinetikk/-dynamikk for aktuelle doseringsregimer for peroral mecillinam. Lysegrønne celler indikerer konsentrasjoner > grenseverdi, mens lyserøde indikerer konsentrasjoner < grenseverdi. De siste radene viser estimert %T>MIC for de ulike cut-off.
|
Dose |
200 mg x 3 po |
400 mg x 3 po |
400 mg x 4 po |
|
Doseringsintervall |
8 timer |
8 timer |
6 timer |
|
~CMAX [mg/L] |
2 |
4 |
4 |
|
Halveringstid 1 [mg/L] |
1 |
2 |
2 |
|
Halveringstid 2 [mg/L] |
0,5 |
1 |
1 |
|
Halveringstid 3 [mg/L] |
0,25 |
0,5 |
0,5 |
|
Halveringstid 4 [mg/L] |
0,125 |
0,25 |
0,25 |
|
Halveringstid 5 [mg/L] |
0,064 |
0,125 |
0,125 |
|
Halveringstid 6 [mg/L] |
0,032 |
0,064 |
0,064 |
|
Halveringstid 7 [mg/L] |
0,016 |
0,032 |
- |
|
Halveringstid 8 [mg/L] |
0,008 |
0,016 |
- |
|
Estimert %T>MIC |
|||
|
Grense-MIC 0,5 mg/L |
25 % |
37 % |
50 % |
|
Grense-MIC 1 mg/L |
12 % |
25 % |
33 % |
Vedlegg
Tabell 3. Utdrag fra NordicAST brytningspunkttabeller v. 13.0 (www.nordicast.org)
|
Penicillins |
MIC breakpoints |
Disk content (µg) |
Zone diameter breakpoints (mm) |
||||
|
S ≤ |
R > |
ATU |
S ≥ |
R < |
ATU |
||
|
Mecillinam p.o. (pivmecillinam) (uncomplicated UTI only), E. coli, Citrobacter spp. Klebsiella spp., |
8 |
8 |
|
10 |
15 |
15 |
|
|
Kommentarer |
|
|
Se bort fra enkeltkolonier i hemningssonen. |

Figur 3. MIC-distribusjon fra EUCAST (mic.eucast.org) for mecillinam/Escherichia coli. ECOFF 0,5 mg/L [CI 0,25-0,5]

Figur 4. Sonediameter-distribusjon fra EUCAST (mic.eucast.org) for mecillinam/Escherichia coli. ECOFF 20 mm [CI 20-21]

Figur 5. Korrelasjon mellom MIC (Agarfortynning) og sonediameter (lappediffusjon) fra EUCAST (www.EUCAST.org) - "Enterobacterales, Calibration of zone diameter breakpoints to MIC values”, Version 11.0, February 2023
