Resistenstesting av vankomycin på MRSA-isolater i Norge
Publisert Januar 2014 i samarbeid med referanselaboratoriet for MRSA, St. Olavs hospital.
EUCAST og NordicAST opererer med et klinisk brytningspunkt på S ≤ 2mg/L for vankomycin hos S. aureus. Brytningspunktet er satt ned slik at den tidligere intermediærkategorien er fjernet. Referanselaboratoriet for MRSA har ikke til nå rutinemessig undersøkt alle innsendte isolater for vankomycinresistens, men ønsker å optimalisere påvisningen og overvåkningen av vankomycinresistens hos MRSA i Norge. Det er nylig publisert et NordicAST dokument for påvisning av glykopeptidresistens hos S. aureus. Nedenfor følger en kort beskrivelse av vankomycinresistens hos S. aureus, metoder for påvisning og forslag til når det er aktuelt å sende inn stammer til referanselab.
Resistensmekanismer og forekomst
Mekanismene for vankomycinresistens hos S. aureus er ulike, og gjenspeiler seg dels i MIC-verdien. Per i dag er følgende grupper/kategorier beskrevet:
- VRSA: Vankomycinresistent S. aureus
S. aureus isolat med høygradig resistens (MIC >8 mg/L) mot vankomycin. Skyldes
tilstedeværelse av vanA genet. - VISA: Vankomycin intermediær S. aureus
S. aureus med lavgradig vankomycinresistens (MIC 4-8mg/L). Skyldes endringer i
celleveggen. Klinisk resistent i henhold til brytningspunkt fra EUCAST/NordicAST. - hVISA: heteroresistent vankomycin intermediær S. aureus
S. aureus som er in vitro sensitiv for vankomycin (MIC ≤ 2 mg/L), men med en subpopulasjon (1 av 106 celler) som har vankomycin MIC >2 mg/L påvist med populasjonsanalyse undersøkelse (PAP-AUC). Skyldes endringer i celleveggen.
Estimert forekomst av hVISA i Europa er på < 2 % uten at dette har vært undersøkt systematisk. For VISA er forekomsten lavere, < 0,1 %. VRSA har ikke blitt påvist i Europa ennå, og er fortsatt sjelden på verdensbasis (1).
Metode for påvisning av vankomycinresistens hos S. aureus
Vankomycin MIC påviser kun VRSA og VISA. Buljongfortynningsmetodikk er gullstandarden. Gradientmetodikk vil kunne overestimere MIC verdien med 0,5-1 fortynningstrinn sammenliknet med buljongfortynning, men noen hevder at MIC bestemt ved gradientmetodikk er mer presis i å forutsi terapisvikt med vankomycin enn MIC bestemt ved buljongfortynningsmetodikk (2,3).
Også buljongfortynningsmetodikk vil ha en iboende metodeusikkerhet på ett fortynningstrinn i hver retning fra MIC, slik at en andel av isolat med MIC på 2 mg/ L i noen tilfeller vil teste som 1 mg/L eller 4 mg/L.
Screeningtest for hVISA
For å påvise hVISA fins det flere alternative screeningmetoder, de fleste beskrevet i et review av Howden i 2010 (1). Metodene har til felles at de bruker ulike kombinasjoner av enten høyere inokulat, lengre inkubasjon og/ eller rikere medier for å detektere den resistente subpopulasjonen. Metodenes sensitivitet og spesifisitet varierer i og mellom studier, og det finnes ingen etablert gullstandard.
- MakroGradient Test (MET). Bruker 2McFarland, leses av etter 48 timer.
- Glykopeptid resistent deteksjons gradient test (GRD-test). Bruker 0,5 McFarland.
Leses av ved 24 og 48 timer. - Screening agar: Brain Heart Infusion agar med vankomycin 4mg/L og Casein 16mg/L er anbefalt som alternativ i NordicAST dokumentet (4).
EUCAST anbefaler i sitt metodedokument Muller Hinton agar med 5mg/L teicoplanin (1).
Basert på egen utprøving av ulike glykopeptid resistens screeningagarer ved MRSA referanselaboratoriet i 2011, vil vi primært anbefale laboratoriene å benytte MET eller GRD-test som screening for hVISA da det generelt var problemer med dårlig sensitivitet og / eller spesifisitet for mange av screeningagarene (upubliserte data).
Konfirmasjonstest for hVISA
Positiv screeningtest for hVISA skal bekreftes med en populasjons analyse profil (PAP-AUC). Undersøkes ved referanselaboratoriet for MRSA. Metoden regnes som den mest nøyaktige i å påvise hVISA, men er både arbeids- og tidkrevende, og svar kan neppe forventes innen et klinisk relevant tidsperspektiv.
Hvilke MRSA isolater skal testes for vankomycinresistens, og hvor skal det utføres?
Kostnad og nytteverdi må vurderes når en ser på i hvor stor grad man skal lete etter hVISA hos MRSA. Mange tilfeller av hVISA har blitt påvist hos pasienter under pågående behandling. Infeksjoner assosiert med biofilm, infeksjoner med høyt bakterietall og/eller infeksjoner som krever langvarig antibiotikabehandling vil ha antatt høyere risiko for forekomst av hVISA. Vankomycin MIC er med i AFAs anbefalte resistenspanel for MRSA, og følges dette vil en påvise VRSA og VISA, men ikke hVISA i rutinen.
Nytten av å undersøke for hVISA hos alle MRSA koloniseringsstammer er diskutabel. En vil da bruke betydelige ressurser for å lete etter noe som opptrer sjelden, og ikke vil ha klinisk konsekvens for de aller fleste.
Alle med invasiv MRSA infeksjon og/eller MRSA infeksjon der vankomycin er aktuelt i behandlingen bør testes for vankomycinresistens med MIC bestemmelse og screening for hVISA. Dette bør gjøres på primærlaboratoriet, eventuelt et laboratorium som primærlaboratoriet har avtale med. Dersom forhøyet MIC (>2 mg/L) eller positiv screeningtest for hVISA, anføres dette på skjemaet som følger isolatet til referanselaboratoriet sammen med opplysninger om MIC verdi og screeningmetode benyttet. Referanselaboratoriet vil da gjenta screeningtest, eventuelt bruke en alternativ screeningtest enn det
primærlaboratoriet benyttet, og ved positivt resultat følge opp med PAP/AUC.
Ved terapisvikt med vankomycin er det viktig å utføre ny test for hVISA i nye positive oppvekstkulturer. Særlig hvis MIC verdi i første prøve er >2, er det vist økt risiko for forekomst av hVISA.
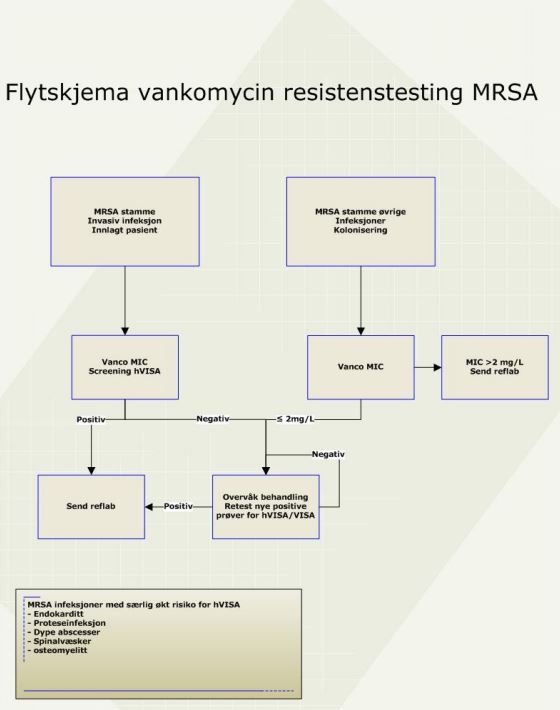
Forslag til flytskjema for påvisning av vankomycinresistens hos MRSA
Referanser:
- Howden BP, Davies JK, Johnson PDR et al. Reduced vancomycin susceptibility in Staphylococcus aureus, including vancomycin-intermediata and heterogeneous vancomycin-intermediate strains: resistance mechanisms, laboratory detection and clinical implications. Clin Microbiol rev 2010; 23: 99-139.
- Holmes NE, Johnson PDR, Howden B. Relationship between Vancomycin-resistant Staphylococcus aureus, vancomycin-intermediate S. aureus, High vancomycin MIC, and outcome in serious S. aureus infections. J Clin Microbiol 2012; 50: 2548-2552.
- Van Hal SJ, Lodise TP, Paterson DL. The clinical significance og vancomycin minimum inhibitory concentration in Staphylococcus aureus infections: a systematic review and meta-analysis. Clinical Infectious Diseases 2012; 54: 755-71.
- Satola SW, Farley MM, Anderson KF, Patel JB. Comparison of detection methods for heteroresistant Vancomycin-Intermediate Staphylococcus aureus, with the population analysis profile method as the reference method. J Clin Microbiol 2011; 49: 177-183.
- Howden BP, Peleg AY, Stoinear TP. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infect. Gent. Evol 2013, http://dx.doi.org/10.1016/j.meegid.2013.03.047.
